2023年5月,动脉网关注到核药领域一则最新讯息,晶核生物宣布其利用自有技术平台开发的「镥 [177Lu]JH020002 注射液」(管线代号为:JH02)产品临床申请正式取得CDE受理。
.png)
CDE公示信息
据悉,JH02适应症为前列腺癌,属于RDC(靶向放射性核素疗法,也称“TRT”)范畴——这是目前临床实操中唯一能够实现诊疗一体化的药物。作为一类创新PSMA靶向核素药物,JH02与诺华2022年获批FDA的Pluvicto同类,据介绍,JH02在动物实验中表现出更高的使用剂量安全性、更优的治疗效果及更简单的生产工艺。
JH02获CDE审理,也标志着中国创新靶向核药的自主研发正加速向临床阶段迈进,填补了国内诊疗一体核药研发空白。
成立于2021年的晶核生物,在一年内完成2轮超亿元融资,用一年半的时间将JH02推进至递交中美双报IND,发展速度迅猛。值此契机,动脉网有幸采访到晶核生物联合创始人&首席技术官王羽博士,探寻晶核生物的发展脉络。

曾主导推进Pluvicto,
具备超20年核药研发经验
Pluvicto,于2022年获FDA批准上市,用于治疗PSMA阳性,且经过紫杉烷类化疗和雄激素受体信号通路抑制剂治疗的转移性去势抵抗性前列腺癌(mCRPC)患者,是首款FDA批准用于治疗这类mCRPC患者的靶向放射性疗法(RDC)。
Pluvicto是诺华推出的第二款RDC药物,2022年营收为2.71亿美元。据诺华预计Pluvicto的最高销售额将超过20亿美元,被视为下一个20亿美元重磅药物。
Pluvicto最初由德国公司ABX开发,2017年被美国公司Endocyte收购。Endocyte是一家开发小分子偶联药(SMDC)的企业,最早用叶酸偶联药物治疗叶酸受体高表达肿瘤。“ABX正在做临床Ⅰ期时我们就注意到了这个项目,了解到背景和实验情况后帮助ABX完成了临床Ⅰ期和其他临床试验。”彼时在Endocyte担任研究导师的王羽博士说。
收购Pluvicto前,以王羽博士为主导的团队做了大量的相关研究,并且联合申办了多个临床试验对pluvicto进行验证,“一是与ABX合作评价临床前数据及临床数据,帮助选择适应症;二是制定临床试验策略,同时开发了备选药物,以防原有药物在临床中出现问题。”王羽博士说。在药物研发过程中,临床试验策略至关重要,要全面制定一种协调整合的临床试验策略,让临床试验实施方可以更好满足所有相关方的需求,包括患者、试验点和主要研究人员的需求,从而顺利达到临床终点。
完成Pluvicto临床Ⅱ期试验后,2018年,诺华以21亿美元的高价收购Endocyte,并获得了Pluvicto。2022年3月,诺华完成临床Ⅲ期试验后成功取得FDA批准上市。Pluvicto的成功,一方面得益于PSMA靶点是前列腺癌治疗中较为成熟的靶点,另一方面得益于恰好发现了天然高亲和、高内吞的多肽前体,经过一系列优化改造,使其成药性更佳。
在Endocyte负责主导推进Pluvicto的王羽博士毕业于加拿大Queen’s University大学,师从加拿大皇家学会院士Erwin Buncel教授。毕业后王羽先后在三家美国制药公司述职,在礼来参与了抗抑郁症重磅药物杜洛西汀(cymbalta)的研发,后在Endocyte的十多年里专注于小分子偶联药和靶向放射性核素药物的开发,针对包括肿瘤、自身免疫性疾病和炎症在内的多种疾病。
四位科学家联合
涵盖制药全领域
Endocyte被收购前,积累了20年核药研发经验的王羽博士逐渐萌发了回国创业的想法。2018年王羽博士曾带着几款其主导研发的临床药物到国内寻找合作机会,尽管最后公司被收购后停止寻求合作,“但在多次的往返国内的过程中,与余海华博士结识,并开始就创业进行了深入沟通。”王羽说。
余海华是复旦大学药物化学博士,具有15年新药研发经验。曾在跨国药企GSK担任新药研发科学家,后陆续在华益科技、华景分子影像与药物研究院任职,成功搭建了靶向放射性核药一体化CDMO平台和分子影像临床前药物评价平台,主要涉及领域包括神经退行性疾病诊断及治疗药物和放射性核素药物的研发。
核药由靶向配体、连接臂(linker)和放射性核素组成,靶向配体药物包含生物及化学药物两种。有了整体核药开发经验和前期开发经验的王羽和余海华很快结识了擅长研发化药和生物药的王彦军博士和何进秋博士。
王彦军博士毕业于University of North Texas,师从著名核药专家Mark M. Goodman进行博士后研究,后在美国多家制药企业负责小分子药及核药研发,具有近20年新药研发经验。王彦军有多款NCE(新化学实体)药物进入IND,其中三个NDA药物已被FDA批准上市,具有29项美国药物发明专利。
何进秋博士毕业于复旦大学,在生物医药早期研发和靶点筛选方面有十多年的从业经验。曾在罗氏、GSK、和铂医药等制药公司主导参与了多种抗体和小分子药物的研发,涉及肿瘤、中枢神经疾病等领域,多个研发药物已进入临床试验阶段。
从2018年起,怀揣着创业想法的四位科学家保持沟通,积极筹备,终于在三年后成功创办晶核生物,并立刻获得了多家投资机构的青睐,包括高榕资本、VI Ventures、骊宸资本、凯泰资本和沂景资本等。
瞄准RDC趋势,最快管线药效、安全性及治疗范围更佳
放射性核素偶联药物(Radionuclide Drug Conjugates, RDC)是目前核药靶向治疗领域中最具潜力的发展方向之一,主要由靶向定位元件(抗体或小分子)、连接臂(linker)、螯合剂和放射性同位素四个部分组成,分为核素抗体偶联药物(RAC)和基于小分子(包括多肽)的核素偶联药物。
RDC与抗体偶联药物具有相似性,ADC的payload通常为微管毒素等,通过抑制细胞分裂抵抗肿瘤,RDC则是由放射性射线能量杀死快速分裂和生长的肿瘤细胞,相对ADC而言耐药性更低。
核药的诊疗一体化趋势要求药物能够同时实现可视化和精准治疗,而RDC是临床中唯一能够实现诊疗一体化的核药。RDC通过装载半衰期较短的同位素,药物迅速从血液进入靶组织,与原位肿瘤或继发肿瘤相结合,可在极短半衰期内给出信号并通过分子影像学得出全面医学影像结果。在只更换核素、相关靶头与linker保持相同的情况下,还可以实现精准治疗的目的。如连接氟[18F]、镓[68Ga]等构成诊断产品,精准靶向的位置,连接镥[177Lu]、锕[225Ac]构成治疗产品,方便医生给患者精准用药。
近日CDE受理的JH02([177Lu]JH020002)是晶核生物推进最快的药物研发管线,靶点为PSMA。PSMA是前列腺特异性膜抗原,通常在前列腺癌细胞中表达水平较高,约有95%PSMA存在于前列腺癌细胞表面,这使其成为放射性药物治疗的理想靶点。
据世界卫生组织发布数据显示,2020年全球男性前列腺癌新增141万人,已成为世界范围内男性发病率第二高的恶性肿瘤。在近日发布的《2022年浙江省肿瘤登记年报》中,过去8年间前列腺癌发病率逐年上升,已从14.93/10万人增至18.25/10万人。
基于开发Pluvicto经验研发的JH02适应症同样为前列腺癌,从零到递交中美双报、获得CDE受理仅用了一年半时间,“在动物模型对比实验中,各方面的数值显现出了更高的使用剂量安全性和更优的治疗效果。”王羽说。
“Pluvicto主要用于转移性去势抵抗性前列腺癌,针对的是PSMA表达水平较高的晚期癌症病人,在PSMA表达水平较低的动物模型中并没有表现出活性。但JH02不仅在PSMA表达水平高的动物模型中表现出高于pluvicto的活性,在PSMA表达水平低的动物模型中也表现出明显活性,这使得JH02具备了针对PSMA表达较低的前、中期前列腺癌的潜力,为更广大的病人群体提供更多、更好的治疗方案。”王羽补充。
要说其药效更高的根本原因,还是在晶核生物已搭建出的四大特色技术平台。
四大技术平台加速RDC药物开发
正在布局多个管线
围绕核药组成部分,晶核生物搭建出J-Linker多功能偶联平台、配体筛选平台、同位素标记平台及影像评价平台四大平台。
配体筛选平台,用于高效筛选适合RDC药物的靶向配体,同位素标记平台能够快速、稳定且高效配合RDC的诊断性或治疗性需求,利用影像评价平台可以整体测试RDC的活性及安全性,生成有效参数以供技术迭代优化。
“影响RDC药物亲和力的除了靶向配体外,linker也是重要的影响因素之一。”王羽说。虽然linker既不具备配体的靶向性,也不具备放射性核素的杀伤性,但linker的作用不仅仅是连接配体和核素,而是直接影响到RDC药物的成药性。
基于Endocyte在linker领域中20余年的研究经验,王羽主导开发出J-Linker多功能偶联平台,这个平台可以快速定点连接靶向配体、螯合剂和放射性核素,调节RDC药物所需的理化特性,从而使药物具备更好的亲和力、更优的PK和更高的稳定性等。
四大平台的整体应用,帮助晶核生物大大提高了研发效率,缩短研发周期,同时降低成本,提高成功率。除了已获得CDE受理的JH02外,晶核生物正在推进多个实体瘤管线。
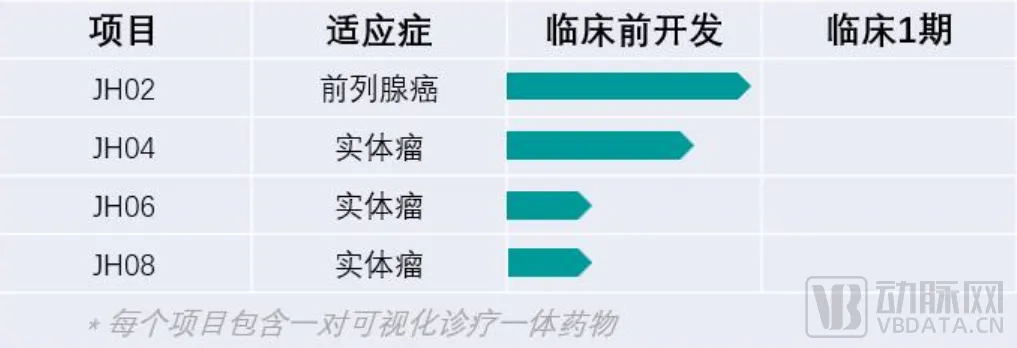
晶核生物药物管线
“其他的三条管线正在快速推进,最快的一条即将进入PCC确认阶段,每条管线都具备针对五个以上适应症的可能性。”王羽说。未来,晶核生物将继续深入RDC药物的开发,打造有创新性、差异性的药品,为全球患者提供更多治疗方案。